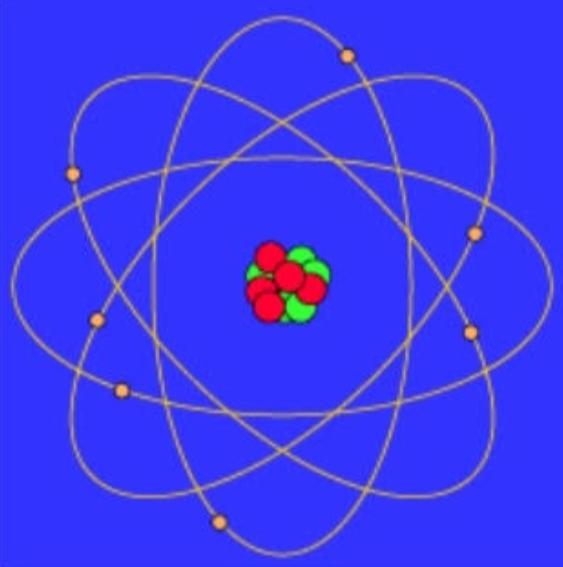
Bohr Atom Modelinin Eksiklikleri Konusu
Bohr Atom Modelinin Eksiklikleri Konusu
Bohr Atom Modelinin Eksikliklerinin Çözülmesi
Niels Bohr tarafından 1913’te önerilen Bohr Atom Modeli, atom yapısının anlaşılmasında önemli bir dönüm noktası oldu.Elektronların atomlar içindeki davranışlarını anlamak için bir çerçeve sağladı ve modern kuantum mekaniğinin temelini attı.Bununla birlikte, çığır açan doğasına rağmen, Bohr Modeli sınırlamaları olmadan değildir. Bu makalede, Bohr modelinin eksikliklerini inceliyoruz ve kuantum teorisindeki sonraki gelişmelerin açıklayıcı gücünü nasıl aştığını araştırıyoruz.
Elektron Yörüngeleri için Açıklama Eksikliği:
Bohr Modelinin temel yönlerinden biri, kuantize elektron yörüngeleri kavramıdır.Bohr, elektronların çekirdeğin etrafında, her biri belirli bir enerji seviyesine karşılık gelen sabit yörüngelerde döndüğünü öne sürdü.Bununla birlikte, model, klasik fiziğin tahmin edeceği gibi, elektronların neden bu ayrık yörüngeleri işgal ettikleri ve elektromanyetik radyasyon nedeniyle çekirdeğe neden sarılmadıklarına dair tatmin edici bir açıklama sağlayamamaktadır.
Elektron Dönüşünün Hesaba Katılmaması:
Bohr Modelinin bir diğer önemli kusuru, elektron dönüşü kavramını dahil edememesidir. Model, elektronları dairesel yörüngelerde hareket eden ve içsel açısal momentumlarını ihmal eden nokta parçacıkları olarak ele alır.Parçacıkların temel bir özelliği olan elektron dönüşü, atomların davranışlarını ve etkileşimlerini belirlemede çok önemli bir rol oynar, ancak Bohr’un orijinal formülasyonunda hesaba katılmamıştır.
Multielektron Atomlarının Yetersiz Tanımı:
Bohr Modeli, tek elektronlu bir atom olan hidrojenin spektral çizgilerini başarıyla açıklarken, birden fazla elektronlu atomlara uygulandığında önemli zorluklarla karşılaşır.Bu atomlar, Bohr Modelinin basit çerçevesi kullanılarak doğru bir şekilde tahmin edilemeyen daha karmaşık enerji seviyesi yapıları ve spektral desenler sergiler.Bohr’un modelinde, çoklu elektronlar ve bunların ilgili enerji seviyeleri arasındaki etkileşimler hesaba katılmaz ve uygulanabilirliğini daha karmaşık atomik sistemlerle sınırlar.
Kuantum Mekanik Prensiplerin Cehaleti:
Bohr Modeli, kuantum mekaniğinin ilkelerinin henüz emekleme döneminde olduğu bir zamanda ortaya çıktı. Bohr, nicelenmiş enerji seviyeleri kavramını ortaya koyarken, modeli büyük ölçüde çekirdek ve elektronlar arasındaki elektrostatik çekim ve açısal momentumun korunması gibi klasik fizik ilkelerine dayanıyordu.Bununla birlikte, kuantum mekaniği geliştikçe, parçacıkların atom ölçeğindeki davranışının, Bohr Modelinin deterministik çerçevesiyle bağdaşmayan kavramlar olan olasılıksal dalga fonksiyonları ve belirsizlik ilkeleri tarafından yönetildiği ortaya çıktı.
Sınırlı Tahmin Gücü:
Hidrojen spektrumunu açıklamadaki ilk başarısına rağmen, Bohr Modelinin öngörücü gücü, daha karmaşık atom olaylarına uygulandığında sınırlıdır.Spektral çizgilerdeki ince ve aşırı ince yapı, elektron-elektron etkileşimleri ve atomların dış alanlardaki davranışları gibi olayları açıklayamaz.Deneysel teknikler ilerledikçe, Bohr Modelinin tahminleri ile gözlemlenen fenomenler arasındaki tutarsızlıklar giderek daha belirgin hale geldi ve atomik davranışın karmaşıklıklarını tanımlamadaki yetersizliklerini vurguladı.
Bohr Atom Modeli, atom yapısı anlayışımızda önemli bir ilerlemeyi temsil etse de, kusurları olmadan değildir.Elektron davranışını tam olarak açıklayamaması, kuantum mekaniksel ilkelerin ihmal edilmesi ve sınırlı tahmin gücü, onu atom sistemlerinin inceliklerini tanımlamak için yetersiz kılar.Schrödinger denklemi ve kuantum alan teorisi gibi kuantum teorisindeki sonraki gelişmeler, Bohr Modelinin açıklayıcı gücünü aşarak atom fenomenlerini anlamak için daha kapsamlı çerçeveler sağlamıştır.Bununla birlikte, Bohr’un modeli bilim tarihinde önemli bir kilometre taşı olmaya devam ediyor ve kuantum mekaniği alanında daha fazla keşif ve keşfin önünü açıyor.