Atom Modelleri Konusu
Atom Modelleri Konusu
Kimyada Atom Modellerini Anlama
Maddenin ve özelliklerinin incelenmesi olan kimya, tüm maddenin temel yapı taşı olan atom aleminin derinliklerine iner.Yüzyıllar boyunca bilim adamları, atomların yapısını kavramsallaştırmak ve açıklamak için çeşitli atom modelleri geliştirdiler.Bu modeller, atomik yapı anlayışımız büyüdükçe, erken spekülasyonlardan modern, iyi desteklenen teorilere doğru geliştikçe gelişti.
Dalton’un Bilardo Topu Modeli
19. Yüzyılın başlarında John Dalton, atomları bilardo topları gibi bölünmez, katı küreler olarak tasavvur eden ilk atom modelini önerdi.Bu model, farklı elementlerin atomlarının farklı kütlelere sahip olduğunu ve bileşikler oluşturmak için sabit oranlarda birleştirildiğini öne sürdü. Çığır açarken, Dalton’un modeli atomik davranışın karmaşıklıklarını açıklamak için gereken karmaşıklıktan yoksundu.
Thomson’ın Erikli Puding Modeli
Dalton’un çalışmalarına dayanan J.J. Thomson, 20. yüzyılın başında Erikli Puding Modelini tanıttı.Thomson, atomların “erik” gibi gömülü negatif yüklü elektronlarla pozitif yüklü bir “pudinge” benzediğini öne sürdü.” Bu model elektronların keşfinden sorumluydu, ancak atom içindeki pozitif yük dağılımını açıklayamadı.
Rutherford’un Nükleer Modeli
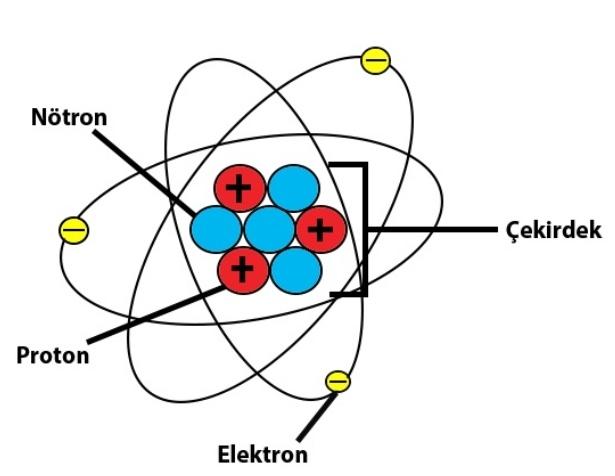
Ernest Rutherford’un 1909’daki altın folyo deneyi atom teorisinde devrim yarattı.Gözlemleri, bir atomu, merkezinde küçük, yoğun bir çekirdeği olan, pozitif yüklü ve atomun kütlesinin çoğunu içeren, çoğunlukla boş bir alan olarak tasavvur ettiği Nükleer Modele yol açtı.Elektronlar, güneş’in etrafındaki gezegenler gibi, çekirdeğin etrafında bir mesafede döndüler.Bu model deneysel sonuçları başarıyla açıkladı, ancak yörüngedeki elektronların stabilitesini açıklamada zorluklarla karşılaştı.
Bohr’un Gezegen Modeli
1913’te Niels Bohr, elektronların çekirdeğin etrafında sabit enerji seviyelerinde veya kabuklarda döndüğünü öne sürerek atom modelini rafine etti.Elektronlar bu seviyeler arasında sıçrayabilir, enerjiyi ayrı miktarlarda emebilir veya yayabilir.Bohr’un modeli, hidrojenin spektral çizgilerini başarıyla açıkladı, ancak sınırlamaları, daha fazla elektronu olan atomlara uygulandığında ortaya çıktı.
Kuantum Mekanik Modeli
1920’lerde geliştirilen Kuantum Mekaniksel Model, atom teorisinde önemli bir sıçramaya işaret ediyordu.Schrödinger, Heisenberg ve diğerlerinin öncülüğünü yaptığı bu model, elektronları orbitaller olarak bilinen olasılık dağılımlarıyla tanımlanan hem parçacıklar hem de dalgalar olarak ele alır.Önceki modellerin aksine, elektronlar için kesin yollar belirtmez, ancak bunları çekirdeğin etrafındaki belirli bölgelerde bulma olasılığını sağlar.
Elektron Bulutu Modeli
Atom yapısının şu anki anlayışı Elektron Bulutu Modelinde kapsüllenmiştir.
Elektron konumlarının olasılıksal doğasını vurgulayan kuantum mekaniği ilkelerini içerir.Elektronlar, orbitaller adı verilen uzay bölgelerinde bulunur ve çekirdeğin etrafında bir bulut oluşturur.Bu model, bir elektronun bir atom içindeki davranışının daha doğru bir şekilde tahmin edilmesini sağlar.
Sonuç olarak, atom modellerinin kimyadaki yolculuğu, bilimsel düşünce ve deneysel tekniklerdeki kayda değer ilerlemeyi yansıtmaktadır.Her model, selefi üzerine inşa edildi ve atomların karmaşık dünyası hakkındaki anlayışımızı geliştirdi.Kuantum Mekaniği ve Elektron Bulutu Modelleri, matematiksel titizlikleri ve öngörücü güçleriyle, çağdaş atom teorisinin temeli olarak duruyor ve çağdaş araştırmalara ve teknolojik gelişmelere rehberlik ediyor.